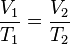Por fin una aportación de un alumno. Jorge Herrero nos manda el siguiente vídeo que explica el origen del universo
Y nos plantea dos preguntas: ¿ para que sirve el acelerador de partículas? ¿ Y si es verdad que ese acelerador podría causar agujeros negros?
Con el acelerador de partículas los científicos esperan resolver secretos como la materia oscura, que forma la mayor parte del Universo, descubrir la antimateria o el famoso bosón de Higgs, también conocido como la "partícula de Dios". La existencia de esa partícula, que debe su nombre al científico que hace 30 años predijo su existencia, se considera indispensable para explicar por qué las partículas elementales tienen masa y por qué las masas son tan diferentes entre sí.
Y no no es posible crear una agujero negro con el acelerador de partículas
Muchas gracias Jorge y te lo recompensaré en las notas de CMC
y finalmente os pongo un video que explica que es la materia oscura y los agujeros negros
Etiquetas
- 1º bachillerato biología (107)
- 1ºESO (2)
- 2º biologia (110)
- 2º QUIMICA (63)
- 2ºgeología (4)
- 3ºESO (23)
- 4º eso (109)
- apuntes 2º bachillerato química (29)
miércoles, 29 de septiembre de 2010
jueves, 23 de septiembre de 2010
REPASO QUÍMICA
En este enlace tienen unos tutoriales y ejercicios para trabajar la estequiometria http://www.eis.uva.es/~qgintro/esteq/esteq.html
Algunos ejercicios con solución:
1.- En 35 g de agua se disuelven 5 g de ácido clorhídrico.La densidad de la disolución resultante es 1,06 g/cm3. Halla la concentración de la disolución: a) en % en masa , b) en g/l , c) molaridad y d) normalidad.
Dato: Mr (HCl) = 36,5 . Sol: a) 12,5 % , b) 132,5 g/l, c) 3,63 M , d) 3,63 N
2- ¿ Qué volumen de ácido nítrico con el 68% de riqueza y 1,4 g/cm3 de densidad se necesita para preparar 3 litros de una disolución 0,5 M de ácido nítrico?.
Dato: Mr (HNO3) = 63 . Sol: 99,26 cc
3.- ¿ Cuál será la molaridad de una disolución de ácido nítrico preparada por dilución a 500 ml, de 32 ml de un ácido concentrado de densidad 1,42 g / cm3 y una riqueza de ácido nítrico de 69,5 %?.
Dato: Mr (HNO3) = 63 . Sol: 1 M.
4.- Por tostación del sulfuro de cinc se obtiene el óxido del metal y se desprende dióxido de azufre. Si se dispone de 8,5 kg de sulfuro:
a) ¿ Qué cantidad de óxido se producirá?. b) ¿ Con qué cantidad de oxígeno reacciona?
Sol: a) 7.104 g de ZnO ; b) 4.189 g de oxígeno
5- Halla la pureza de una muestra de sulfato de amonio, de la que tomados 13,162 g y tratados con exceso de sosa cáustica hacen desprender 3,77 l de amoniaco, medidos a 18ºC y 742 mmHg, si además se origina sulfato de sodio y agua. Sol: 77,3 %
6- Calcula la cantidad de caliza cuya riqueza en carbonato cálcico es del 85,3 %, que se necesita para obtener, por reacción con un exceso de ácido clorhídrico, 10 litros de dióxido de carbono, medido a 18ºC y 752 mmHg. Sol: 48,6 g
7.- Se hacen reaccionar 200 g de una caliza que contiene un 60 % de carbonato cálcico con una disolución de ácido clorhídrico al 30 % en peso y densidad 1,15 g /cc . Calcula:
a) volumen de CO2 obtenido, a 18 ºC y 2 atm. b) volumen de la disolución de ácido clorhídrico consumido. c) si en la práctica se obtuvieron 100 g de CaCl2 . ¿Cuál es el rendimiento de la reacción ?. Sol: a) 14,31 l , b) 253,91 cm3 , c) 75 %
lunes, 20 de septiembre de 2010
LEYES DE LOS GASES
A) Ley (Hipótesis) de Avogadro: “Volúmenes iguales de gases, medidos en las mismas condiciones de P y T , contienen el mismo número de moléculas y por tanto de moles”, es decir, a P y T constantes, el volumen ocupado por un gas es directamente proporcional al número de moles
B) Ley de Boyle-Mariotte: “ Para una determinada masa de gas, a T constante, la presión es inversamente proporcional al volumen”.
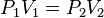
C) Ley de Charles y Gay-Lussac: “ Para una determinada masa de gas, a P constante, el volumen es directamente proporcional a la temperatura absoluta”.
2ª Ley de Gay-Lussac: “Para una determinada masa de gas, a V constante, la presión es directamente proporcional a la temperatura absoluta”.
Todas estas leyes pueden reunirse en la llamada ecuación de estado de los gases ideales: P.V= nRT
Para una misma masa de gas se cumple que p1.V1/T1= P2.V2/T2
En condiciones normales (273K y 1 atm) volumen de un mol de cualquier gas ocupa 22,4 l ( volumen molar)
Un gas ideal es un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Las leyes de los gases también se aplican a las mezclas de gases: la presión total es la suma de las presiones parciales de cada gas ( ley de Dalton)
Se define presión parcial de un gas como aquella que ejercería si ocupara él solo el recipiente
PT = PA + PB + PC + ..
PA = XA · PT =(na/nt) . PT
Ejemplos con solución
1.- Un neumático de una motocicleta tiene un volumen de 10 litros y se llena de aire a una presión de 3 atm, a 27ºC. Después de circular varias horas, la T se eleva a 57ºC y el volumen se supone invariable. Calcula: a) la presión que habrá en el neumático, b) el volumen del gas si la presión hubiera aumentado sin variar la T.
Sol: a) 3,3 atm , b) 9,09 litros.
2- Calcula la densidad del vapor del alcohol etílico cuando se encuentra en un recipiente cerrado:Ejemplos con solución
1.- Un neumático de una motocicleta tiene un volumen de 10 litros y se llena de aire a una presión de 3 atm, a 27ºC. Después de circular varias horas, la T se eleva a 57ºC y el volumen se supone invariable. Calcula: a) la presión que habrá en el neumático, b) el volumen del gas si la presión hubiera aumentado sin variar la T.
Sol: a) 3,3 atm , b) 9,09 litros.
a) a 0,8 atm y 37 ºC, b) en c.n. .
Datos: mat C =12 , O=16 , H = 1 .
Sol: a) 1,45 g/l , b) 2,05 g/l
3.- Un matraz de vidrio pesa vacío 21,786 g, lleno de nitrógeno pesa 22,473 g y lleno de un gas desconocido, en las mismas condiciones de P y T, pesa 22,957 g. Halla la masa molecular del gas.
Dato: mat N = 14. , Sol: 47,7
4- La composición volumétrica (molar) de una mezcla gaseosa es la siguiente: 30 % de metano, 50 % de dióxido de carbono y 20% de monóxido de carbono. Si la presión total es de 2 atm ¿ cuál es la presión parcial de cada uno de los gases?.Dato: mat N = 14. , Sol: 47,7
Datos : mat C = 12 , O = 16 , H = 1 u
Sol: 1,01 atm , 0,61 atm , 0,38 atm
Además si queréis comprender un poco mejor estas leyes os recomiendo estas dos páginas dónde podréis ver algunas animaciones y experimentos virtuales:http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/index.html
http://www.educaplus.org/gases/index.html
viernes, 17 de septiembre de 2010
FÓRMULAS EMPIRICAS Y MOLECULARES
Cálculo de la fórmula empírica.
1.Conociendo el porcentaje de cada elemento en el compuesto y las masas relativas de los elementos podemos calcular el número relativo de átomos de cada elemento del compuesto dividiendo el tanto por ciento de cada elemento entre su masa atómica relativa. (
2.Dividimos el resultado obtenido por el valor más pequeño de todos. (esto nos da la relación de átomos de cada elemento respecto a la de uno concreto)
3.Y si el resultado no es un número entero, como no podemos tener por ejemplo 0,9 átomos, se multiplican los resultadosobtenidos por un número entero 2, 3, 4, etc. Hasta que todos sean números enteros.
Cálculo de la fórmula molecular.
1.Para calcular la fórmula molecular primero hemos de conocer la masa molecular del compuesto.
2.Después aplicamos la siguiente fórmula: masa molecular = masa (fórmula empírica) x n donde n es el número entero por el cual debemos multiplicar la fórmula empírica para obtener la fórmula molecular.
ejercicios con solución:
1.- Un compuesto tiene la siguiente composición centesimal: N = 14,29 % , H = 4,11 % ,
Mo = 48,95 % , O = 32,65 %. Calcula su fórmula. Sol: (NH4)2 MoO4
2.- La masa molar de la aspirina es 180,2 g. Si la composición centesimal es 60 % de C,
4,5 % de H, y 35,5 % de O. ¿Cuáles son las fórmulas empírica y molecular?. Sol: C9H8O4
3.- En 4,83 g de un hidrocarburo gaseoso hay 4,14 g de carbono. Halla su fórmula
molecular si esos gramos del mismo, a 18ºC y 740 mm de Hg, ocupan un volumen de
2,82 litros. Sol: C3H6
4.- Una muestra de 1,20 g de un compuesto que contiene solo carbono e hidrógeno,
ardió completamente en exceso de oxígeno, dando 3,6 g de CO2 y 1,96 g de H2O. Calcula
la fórmula empírica del compuesto. Sol: C3H8.
Ejemplo: supongamos que tenemos 40,00% de C, 6,67% de H y 53,33% de O. Las masas atómicas son MC=12u, MH=1u, MO=16u.
1.Conociendo el porcentaje de cada elemento en el compuesto y las masas relativas de los elementos podemos calcular el número relativo de átomos de cada elemento del compuesto dividiendo el tanto por ciento de cada elemento entre su masa atómica relativa. (
2.Dividimos el resultado obtenido por el valor más pequeño de todos. (esto nos da la relación de átomos de cada elemento respecto a la de uno concreto)
3.Y si el resultado no es un número entero, como no podemos tener por ejemplo 0,9 átomos, se multiplican los resultadosobtenidos por un número entero 2, 3, 4, etc. Hasta que todos sean números enteros.
Cálculo de la fórmula molecular.
1.Para calcular la fórmula molecular primero hemos de conocer la masa molecular del compuesto.
2.Después aplicamos la siguiente fórmula: masa molecular = masa (fórmula empírica) x n donde n es el número entero por el cual debemos multiplicar la fórmula empírica para obtener la fórmula molecular.
ejercicios con solución:
1.- Un compuesto tiene la siguiente composición centesimal: N = 14,29 % , H = 4,11 % ,
Mo = 48,95 % , O = 32,65 %. Calcula su fórmula. Sol: (NH4)2 MoO4
2.- La masa molar de la aspirina es 180,2 g. Si la composición centesimal es 60 % de C,
4,5 % de H, y 35,5 % de O. ¿Cuáles son las fórmulas empírica y molecular?. Sol: C9H8O4
3.- En 4,83 g de un hidrocarburo gaseoso hay 4,14 g de carbono. Halla su fórmula
molecular si esos gramos del mismo, a 18ºC y 740 mm de Hg, ocupan un volumen de
2,82 litros. Sol: C3H6
4.- Una muestra de 1,20 g de un compuesto que contiene solo carbono e hidrógeno,
ardió completamente en exceso de oxígeno, dando 3,6 g de CO2 y 1,96 g de H2O. Calcula
la fórmula empírica del compuesto. Sol: C3H8.
Ejemplo: supongamos que tenemos 40,00% de C, 6,67% de H y 53,33% de O. Las masas atómicas son MC=12u, MH=1u, MO=16u.
Seguiremos los siguientes pasos:
- Consideramos 100 g de compuesto: el porcentaje de cada uno serán los gramos de cada elemento que hay en 100 g de compuesto. Siguiendo el ejemplo, tendremos 40,00 g de C, 6,67 g de H y 53,33 g de O.
- Dividimos cada masa por la masa atómica del elemento correspondiente:
- Ahora dividimos cada uno de los resultados anteriores por el más pequeño de ellos, en este caso por 3,33:
- El resultado debe ser un número entero, los números enteros más pequeños, y la fórmula empírica sería C1H2O1, quitando los unos quedaría CH2O como fórmula empírica.
jueves, 16 de septiembre de 2010
ORIGEN DEL UNIVERSO
En Ciencias del mundo contemporáneo empezaremos viendo el origen del universo y aunque veremos algún vídeo en clase, éste nos explica muy bien cómo se origina. Me gustaría comentaseis el vídeo ( os lo reconoceré en las notas) y os recuerdo que podéis contribuir con vídeos , enlaces a páginas, artículos... y que serán muy bien recompensadas...
CONCEPTOS DE QUIMICA
1. Masa atómica y molecular
Debido a las dimensiones tan reducidas de los átomos y de las moléculas, y a
que las masas de ambos son del orden de 10-27 Kg, inapreciables por las mas
modernas y precisas balanzas analíticas, para poder trabajar con comodidad,
se ha definido la unidad de masa atómica (uma) como la doceava parte de la
masa del isótopo de carbono 12, al cual se le asigna la masa de 12 umas. Esta
escala de masas atómicas, inicialmente daba el valor 1 a la masa del átomo
más ligero que existe, el Hidrógeno. Es una escala de masas relativas.
La masa molecular se obtiene teniendo en cuenta la masa atómica de cada
elemento que integra el compuesto y el número de átomos que interviene.
Masa del NH3 = 1 x 14 + 3 x 1 = 17 umas.
2. Concepto de mol
Es un concepto fundamental de la Química, y nos permite pasar de la Química
macroscópica, a la química atómica y molecular (submicroscópica).
Número de Avogadro: es el número de átomos contenidos en 12 g del isótopo
de Carbono 12 y tiene un valor NA = 6,023 x 1023
Mol es la cantidad de sustancia que contiene tantas entidades elementales
(átomos, moléculas, iones, etc.) como átomos hay en 12 g del isótopo de
Carbono 12. Por tanto, un mol de átomos contiene 6,023 x 1023 átomos; un mol
de moléculas contiene 6,023 x 1023 moléculas; y un mol de iones contiene
6,023 x 1023 iones, etcétera.
La masa de un mol expresada en gramos se define como masa molar (Mm).
La masa molar coincide con el valor de la masa molecular, aunque la primera
se expresa en gramos mientras que la segunda se expresa en umas. Así, un
mol de amoniaco pesa 17 gramos, mientras que una molécula de amoniaco
pesa 17 umas. En un mol de amoniaco, por otra parte, existen 6,023 x 1023
moléculas.
Por otro lado os doy otros problemas con la solución
1.- a) Un kilogramo de mercurio, ¿cuántos moles son? ¿Y un kilogramo de azufre?
b) 13,2 g de dióxido de nitrógeno ¿cuántos moles son? ¿Cuántos moles de átomos de nitrógeno y de oxígeno hay en dicha cantidad?
Sol. 4,98 moles de átomos , 31,25 moles de átomos; 0,29 mol, 0,29 moles de átomo, 0,58 moles de átomo.
2.- a) Sabiendo que la masa atómica del hidrógeno es 1,00797, calcular la masa, en gramos de un átomo de hidrógeno.
b) ¿Cuál de las siguientes cantidades contiene mayor número de átomos de oro?: 26,02 g de oro; 0,15 moles de átomos de oro; 4,98.1022 átomos de oro.
Sol. 1,67.10-24g; la segunda.
3- Las moléculas de azufre en estado sólido están formadas por ocho átomos. Hallar:
a) cuántos moles son 21,8 g de azufre.
b) cuántos gramos son 0,56 moles de átomos de azufre.
c) el número de átomos contenido en 0,001 g de azufre.
Sol. 0,085 mol; 17,95 g ; 1,88.1019 átomos
Debido a las dimensiones tan reducidas de los átomos y de las moléculas, y a
que las masas de ambos son del orden de 10-27 Kg, inapreciables por las mas
modernas y precisas balanzas analíticas, para poder trabajar con comodidad,
se ha definido la unidad de masa atómica (uma) como la doceava parte de la
masa del isótopo de carbono 12, al cual se le asigna la masa de 12 umas. Esta
escala de masas atómicas, inicialmente daba el valor 1 a la masa del átomo
más ligero que existe, el Hidrógeno. Es una escala de masas relativas.
La masa molecular se obtiene teniendo en cuenta la masa atómica de cada
elemento que integra el compuesto y el número de átomos que interviene.
Masa del NH3 = 1 x 14 + 3 x 1 = 17 umas.
2. Concepto de mol
Es un concepto fundamental de la Química, y nos permite pasar de la Química
macroscópica, a la química atómica y molecular (submicroscópica).
Número de Avogadro: es el número de átomos contenidos en 12 g del isótopo
de Carbono 12 y tiene un valor NA = 6,023 x 1023
Mol es la cantidad de sustancia que contiene tantas entidades elementales
(átomos, moléculas, iones, etc.) como átomos hay en 12 g del isótopo de
Carbono 12. Por tanto, un mol de átomos contiene 6,023 x 1023 átomos; un mol
de moléculas contiene 6,023 x 1023 moléculas; y un mol de iones contiene
6,023 x 1023 iones, etcétera.
La masa de un mol expresada en gramos se define como masa molar (Mm).
La masa molar coincide con el valor de la masa molecular, aunque la primera
se expresa en gramos mientras que la segunda se expresa en umas. Así, un
mol de amoniaco pesa 17 gramos, mientras que una molécula de amoniaco
pesa 17 umas. En un mol de amoniaco, por otra parte, existen 6,023 x 1023
moléculas.
Por otro lado os doy otros problemas con la solución
1.- a) Un kilogramo de mercurio, ¿cuántos moles son? ¿Y un kilogramo de azufre?
b) 13,2 g de dióxido de nitrógeno ¿cuántos moles son? ¿Cuántos moles de átomos de nitrógeno y de oxígeno hay en dicha cantidad?
Sol. 4,98 moles de átomos , 31,25 moles de átomos; 0,29 mol, 0,29 moles de átomo, 0,58 moles de átomo.
2.- a) Sabiendo que la masa atómica del hidrógeno es 1,00797, calcular la masa, en gramos de un átomo de hidrógeno.
b) ¿Cuál de las siguientes cantidades contiene mayor número de átomos de oro?: 26,02 g de oro; 0,15 moles de átomos de oro; 4,98.1022 átomos de oro.
Sol. 1,67.10-24g; la segunda.
3- Las moléculas de azufre en estado sólido están formadas por ocho átomos. Hallar:
a) cuántos moles son 21,8 g de azufre.
b) cuántos gramos son 0,56 moles de átomos de azufre.
c) el número de átomos contenido en 0,001 g de azufre.
Sol. 0,085 mol; 17,95 g ; 1,88.1019 átomos
viernes, 10 de septiembre de 2010
Dios versus ciencia
En esta entrada propongo un tema para un posible debate en clase de ciencias del mundo contemporáneo. La pregunta del debate seria: ¿ es incompatible la idea de dios con los descubrimientos de la ciencia?. Surge de la noticia en la que Stephen Hawking asegura que Dios no creó el universo
Podéis ver la noticia en este enlace: http://www.elpais.com/articulo/sociedad/Dios/creo/Universo/asegura/Stephen/Hawking/elpepusoccie/20100902elpepusoc_6/Tes o en este enlacehttp://www.elmundo.es/elmundo/2010/09/02/ciencia/1283415274.html
Para rebatir esta idea podéis descargar esta presentación que me mandó mi compañera, amiga y profesora del colegio Mercedes Blasco: http://www.slideshare.net/julolisapa/confesin-de-fedegrandescientificos
Podéis ver la noticia en este enlace: http://www.elpais.com/articulo/sociedad/Dios/creo/Universo/asegura/Stephen/Hawking/elpepusoccie/20100902elpepusoc_6/Tes o en este enlacehttp://www.elmundo.es/elmundo/2010/09/02/ciencia/1283415274.html
Para rebatir esta idea podéis descargar esta presentación que me mandó mi compañera, amiga y profesora del colegio Mercedes Blasco: http://www.slideshare.net/julolisapa/confesin-de-fedegrandescientificos
Confesin de fe_de_grandes_cientificos
View more presentations from julolisapa.
lunes, 6 de septiembre de 2010
¿ POR QUE ESTE BLOG?
El objetivo de este blog, es utilizarlo como herramienta que complemente a mis clases y utilizarlo como vía para la divulgación ceintífica. En él publicaré actividades, animaciones , ejercicios y apuntes dados en clase o que no me haya dado tiempo a realizar en clase. Además artículos de interés relacionados con las distintas asignaturas que imparto
Serán bienvenidas cualquier aportación que alumnos o no hagan a este blog.
Tengo mucha ilusión puesta en él y espero que salga lo mejor posible
Serán bienvenidas cualquier aportación que alumnos o no hagan a este blog.
Tengo mucha ilusión puesta en él y espero que salga lo mejor posible
Suscribirse a:
Entradas (Atom)