A) Ley (Hipótesis) de Avogadro: “Volúmenes iguales de gases, medidos en las mismas condiciones de P y T , contienen el mismo número de moléculas y por tanto de moles”, es decir, a P y T constantes, el volumen ocupado por un gas es directamente proporcional al número de moles
B) Ley de Boyle-Mariotte: “ Para una determinada masa de gas, a T constante, la presión es inversamente proporcional al volumen”.
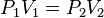
C) Ley de Charles y Gay-Lussac: “ Para una determinada masa de gas, a P constante, el volumen es directamente proporcional a la temperatura absoluta”.
2ª Ley de Gay-Lussac: “Para una determinada masa de gas, a V constante, la presión es directamente proporcional a la temperatura absoluta”.
Todas estas leyes pueden reunirse en la llamada ecuación de estado de los gases ideales: P.V= nRT
Para una misma masa de gas se cumple que p1.V1/T1= P2.V2/T2
En condiciones normales (273K y 1 atm) volumen de un mol de cualquier gas ocupa 22,4 l ( volumen molar)
Un gas ideal es un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Las leyes de los gases también se aplican a las mezclas de gases: la presión total es la suma de las presiones parciales de cada gas ( ley de Dalton)
Se define presión parcial de un gas como aquella que ejercería si ocupara él solo el recipiente
PT = PA + PB + PC + ..
PA = XA · PT =(na/nt) . PT
Ejemplos con solución
1.- Un neumático de una motocicleta tiene un volumen de 10 litros y se llena de aire a una presión de 3 atm, a 27ºC. Después de circular varias horas, la T se eleva a 57ºC y el volumen se supone invariable. Calcula: a) la presión que habrá en el neumático, b) el volumen del gas si la presión hubiera aumentado sin variar la T.
Sol: a) 3,3 atm , b) 9,09 litros.
2- Calcula la densidad del vapor del alcohol etílico cuando se encuentra en un recipiente cerrado:Ejemplos con solución
1.- Un neumático de una motocicleta tiene un volumen de 10 litros y se llena de aire a una presión de 3 atm, a 27ºC. Después de circular varias horas, la T se eleva a 57ºC y el volumen se supone invariable. Calcula: a) la presión que habrá en el neumático, b) el volumen del gas si la presión hubiera aumentado sin variar la T.
Sol: a) 3,3 atm , b) 9,09 litros.
a) a 0,8 atm y 37 ºC, b) en c.n. .
Datos: mat C =12 , O=16 , H = 1 .
Sol: a) 1,45 g/l , b) 2,05 g/l
3.- Un matraz de vidrio pesa vacío 21,786 g, lleno de nitrógeno pesa 22,473 g y lleno de un gas desconocido, en las mismas condiciones de P y T, pesa 22,957 g. Halla la masa molecular del gas.
Dato: mat N = 14. , Sol: 47,7
4- La composición volumétrica (molar) de una mezcla gaseosa es la siguiente: 30 % de metano, 50 % de dióxido de carbono y 20% de monóxido de carbono. Si la presión total es de 2 atm ¿ cuál es la presión parcial de cada uno de los gases?.Dato: mat N = 14. , Sol: 47,7
Datos : mat C = 12 , O = 16 , H = 1 u
Sol: 1,01 atm , 0,61 atm , 0,38 atm
Además si queréis comprender un poco mejor estas leyes os recomiendo estas dos páginas dónde podréis ver algunas animaciones y experimentos virtuales:http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/index.html
http://www.educaplus.org/gases/index.html
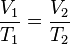
No hay comentarios:
Publicar un comentario