Todos los años al comenzar o finalizar el año me gusta realizar esta entrada con los mejores avances del año y así desearos un FELIZ AÑO 2013
1- Aparece, por fin, el bosón de Higgs
El 4 julio, los físicos de CMS y
ATLAS, los dos mayores experimentos del Gran Colisionador de Hadrones
(LHC), ubicado en el CERN, cerca de Ginebra, en Suiza, confirmaban
emocionados la existencia de una partícula que coincidía con la
descripción teórica del bosón de Higgs.
El hallazgo «bendecía» los conocimientos actuales sobre el mundo
subatómico y, por fin, permitía explicar cómo el resto de partículas
elementales obtiene su masa. Los científicos asumen que existe un campo
energético que permea todo el Universo, el campo de Higgs, por donde las
partículas se mueven como los peces lo hacen en el agua. Cuanto mayor
es la partícula, más resistencia encuentra al moverse. Así, colisionan
con los famosos bosones, que les confieren la materia. En definitiva, el
Higgs es lo que hace que los objetos tengan masa, desde el más diminuto
guijarro de un río hasta la estrella más colosal, incluidos, por
supuesto, nosotros mismos. Sin él, el Universo sería muy diferente al
que conocemos.
Echar un vistazo al bosón de Higgs ha
requerido la participación de miles de investigadores y una inversión
de al menos 5.500 millones de dólares. Aún no está claro a dónde
conducirá este descubrimiento en el campo de la física, pero su impacto
es innegable.
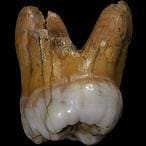
2-El genoma del denisovano, secuenciado
El investigador Svante Pääbo, director del Instituto Max
Planck de Antropología Evolutiva en Leizpig (Alemania), logró secuenciar
el genoma del homínido de Denisova, una misteriosa especie encontrada
en 2010 en Siberia y emparentada con los neandertales, a partir de un
fragmento de un dedo meñique infantil y dos piezas dentales. El análisis
permitió comparar a los denisovanos con el hombre moderno y reveló que
el hueso pertenecía a una niña de ojos marrones, cabello castaño y piel
morena que vivió hace entre 74.000 y 82.000 años.
3- Obtienen óvulos de células madre
Científicos japoneses de la Universidad de Kioto consiguieron fabricar en el laboratorio óvulos fértiles,
con capacidad para ser fecundados, a partir de células madre de ratón.
Los óvulos dieron lugar a una amplia descendencia de ratoncillos sanos.
La investigación puede dar lugar a nuevos tratamientos para combatir la
fertilidad femenina, especialmente en el caso de las mujeres que han
agotado sus óvulos fértiles, por edad o por un tratamiento médico
agresivo.
4- El complejo aterrizaje del Curiosity
El rover Curiosity, el más avanzado creado jamás por la NASA, aterrizó en Marte el
pasado agosto tras realizar una serie de maniobras que nunca antes
habían sido probadas. El descenso era tan peligroso que incluso fue
denominado los «siete minutos de terror». Demasiado pesado para un
aterrizaje convencional, el Curiosity fue descolgado con un complejo
sistema de grúas y correas creado por el equipo del Laboratorio de
Propulsión a Chorro en Pasadena (California). El éxito del aterrizaje
abre la puerta a una nueva misión en Marte para recoger muestras del
terreno y traerlas de vuelta a la Tierra.
5- Rayos X contra la enfermedad del sueño
Un equipo internacional de científicos utilizó un innovador
láser de rayos X en el Laboratorio del Acelerador Nacional SLAC
(California, EE.UU) para revelar la estructura de una enzima clave que
permite al parásito Trypanosoma brucei causar la enfermedad del sueño en
África. El descubrimiento puede abrir una nueva vía de tratamiento
contra la infección, que transmite la mosca Tsé-Tsé a unas 70.000
personas cada año, y revela el potencial de este tipo de láser, mil
millones de veces más brillante que la fuentes sincrotrónicas
tradicionales, para descifrar proteínas.
6- Ingeniería genética más precisa
Científicos de la Universidad de Minnesota (EE.UU.)
desarrollaron una nueva tecnología de edición del genoma denominada
TALENs, más barata y rápida, que permite a los científicos modificar
genéticamente peces cebra, sapos, ganado y otros animales. Los
investigadores pueden alterar o inactivar genes específicos con más
habilidad, lo que también les permitirá aprender más sobre las
enfermedades humanas.
7- Exóticos fermiones dan la cara
La existencia de fermiones de Majorana, partículas que
actúan como su propia antimateria y se aniquilan a sí mismas, ha sido
debatida durante más de siete décadas. Este año, físicos y químicos
holandeses obtuvieron la primera evidencia sólida de que dicha materia
exótica existe, en la forma de quasi-partículas. Los científicos creen
que estas misteriosas partículas pueden ser utilizadas en la computación
cuántica para fabricar equipos más eficientes.
8- El ADN se queda sin basura
El proyecto Encode (Enciclopedia de elementos de ADN), la
investigación de mayor envergadura en la actualidad en el campo de la
genómica, ha conseguido adentrarse en la parte oscura del genoma, que
supone el 98,5% de todo el ADN humano. 30 estudios distintos publicados
simultáneamente en cuatro revista de alto impacto desvelaron que lo que
se consideraba ADN basura no es en absoluto un desecho, sino que juega
un papel clave en la regulación de los genes. El descubrimiento abre la
puerta a descifrar por qué pacientes con la misma enfermedad evolucionan
de forma distinta y podría dar importantes pistas sobre patologías como
la esclerosis múltiple, la enfermedad de Crohn o afecciones cardíacas.
9- El poder de la mente
El mismo equipo de la Universidad Johns Hopkins (Baltimore,
Maryland, EE.UU.) que con anterioridad demostró cómo registros neurales
del cerebro podrían ser utilizados para mover un cursor en una
pantalla, posibilitó en 2012 que personas con parálisis pudieran mover
un brazo mecánico con sus mentes y llevar a cabo movimientos complejos.
La tecnología aún es experimental (y extraordinariamente cara), pero los
científicos tienen la esperanza de que se puedan mejorar estas prótesis
para ayudar a pacientes con apoplejías o lesiones vertebrales.
10- La clave de los neutrinos
Cientos de investigadores que trabajan en el Experimento
Neutrino del Reactor de Daya Bay en China demostraron cómo estas
elusivas y fantasmagóricas partículas que genera, por ejemplo, el Sol, y
atraviesan todo lo que se encuentran se transforman de un «sabor» o
tipo a otro conforme viajan a la velocidad de la luz. Los resultados
sugieren que los neutrinos podrían ayudar en el futuro a explicar por
qué el Universo contiene tanta materia y tan poca antimateria.
RECOGIDO DEL PERIÓDICO ABC: http://www.abc.es/ciencia/20121220/abci-diez-grandes-descubrimientos-cientificos-201212201036.html



















.gif)













